構造原理, パウリの排他原理, フントの規則∣電子配置の決定方法をざっくり解説
構造原理、パウリの排他原理、フントの規則は電子配置を決定する上で必要な理論です。電子配置の決定方法は原子の電子配置だけでなく分子軌道法において電子配置を決定する際にも同じ手順にそって行います。しっかりとマスターしましょう!
電子配置って?
原子において、電子は原子軌道に振り分けられます。電子がどのような軌道に入っているかを示したものを電子配置と言います。

電子配置の決定方法
電子スピン
電子は自転しており、自転の方向には右向き(αスピン)と左向き(βスピン)があります。化学ではαスピンを上向きの矢印(↑)で、βスピンを下向きの矢印(↓)を使って表します。

電子スピンの状態は電子配置の決定の際に必要になりますので必ず覚えておいてください。
電子配置の決定方法
電子配置の決定は以下のルールに従って行います。
電子配置決定のルール
- 電子はエネルギーの低い原子軌道から収容される。(構成原理)
- 一つの軌道には電子が最大で2つ入り、電子のスピン状態は異なる。(パウリの排他原理)
- 電子はスピンを揃えて可能な限り別々の軌道に入る。(フントの規則)
構成原理、パウリの排他原理、フントの規則について、以降 詳しく見ていきましょう!
構成原理とは?
ざっくり
構成原理
電子はエネルギーの低い原子軌道から順に収納される
ちなみに、ここで説明する構成原理、パウリの排他原理、フントの規則を含めて構造原理として説明することもあります。
ちょっと詳しく
原子軌道のエネルギー順はどのような順番になるでしょうか?
基本的には主量子数nの小さい順(K<L<M<N<⋯) に、同じ主量子数では方位量子数lが小さい順(s<p<d<f<⋯)にエネルギーが低くなります。
但し、主量子数の境目では4s軌道より3d軌道のほうがエネルギーが低くなったりエネルギー順が前後してしまう部分があります。
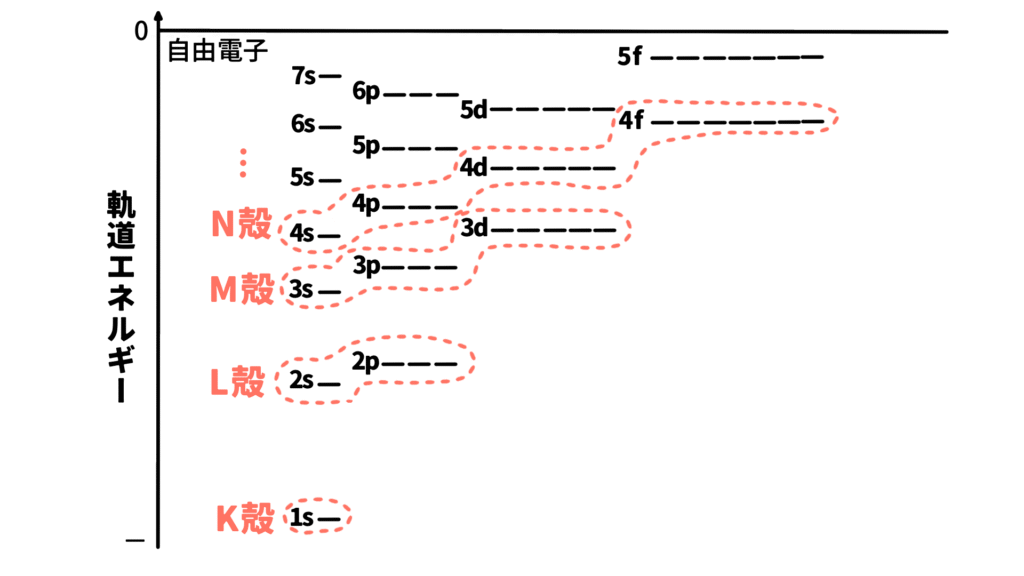
原子軌道エネルギーをそのまま覚えるのは容易ではないため実際には下記の図に示した順に原子軌道を埋めていくと覚えておきましょう。

パウリの排他原理とは?
ざっくり
パウリの排他原理
電子は同一の量子状態を持たない
⇔
一つの軌道には電子が最大で2つ入り、電子のスピン状態は異なる
ちょっと詳しく
パウリの排他原理は素粒子としての電子がフェルミ粒子であることから導かれます。
電子の量子状態は主量子数n, 方位量子数l, 磁気量子数m, スピン量子数msで表されます。
パウリの排他原理によりこれらがすべて一致する量子状態が同時に存在しないということが示されてします。
スピン量子数msは-1/2と1/2の2種類(α及びβ)だけであるので、電子が同一の粒子状態を持たないというのは主量子数n, 方位量子数l, 磁気量子数mの一致する原子軌道においては2種類の量子状態のみが存在し得ることを意味し、つまり
一つの軌道には電子が最大で2つ入り、電子のスピン状態は異なる
ということになります。
フントの規則とは?
ざっくり
フントの規則
縮重(縮退)した軌道に電子が入る時、スピン多重度が最大になるように入る
⇔
電子はスピンを揃えて可能な限り別々の軌道に入る
補足:縮退(縮重)とは
縮退(または縮重)とは、複数の軌道が同じエネルギーを持つ状態を指します。
例えば、p 軌道には px, py, pz の3つの軌道があり、これらはすべて同じエネルギーを持っています。
とは?-1024x576.png)
同様に、d 軌道は5つ、f 軌道は7つあり、それぞれ縮退しています。
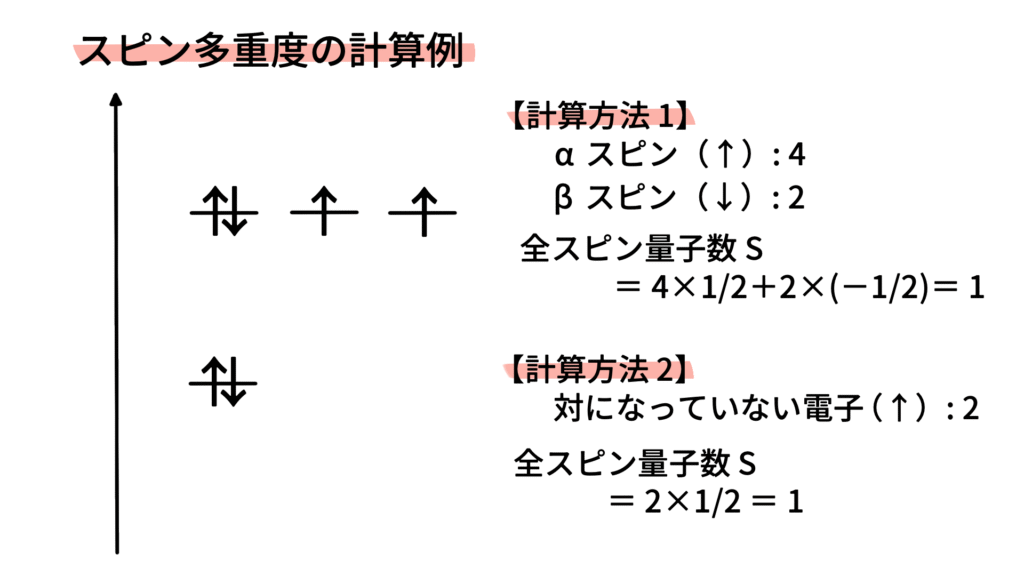
スピン多重度とは
スピン多重度とは、原子や分子が取りうるスピン状態の多様性を示す値で、2S+1 で表されます。
ここで S は全スピン量子数(不対電子のスピン量子数msの合計)です。
下記の例では、αスピン(↑, ms=1/2)がx個, βスピン(↓, ms=−1/2)がy個となるためスピン多重度はxとなります。
ちょっと詳しく
フントの規則は、電子間の反発力を最小限に抑えることで、より安定な電子配置を実現するために重要です。
同じ軌道に2つの電子が入ると、互いの負電荷が反発し合い、エネルギーが高くなります(電子間クーロン反発)。しかし、異なる軌道に分散して入ることで、この反発を避けることができます。

別々の軌道に入った電子のスピンの向きが異なる場合、異なる軌道間での電子移動が起こりやすく結果としてクーロン反発が起こることで安定性が低下します。
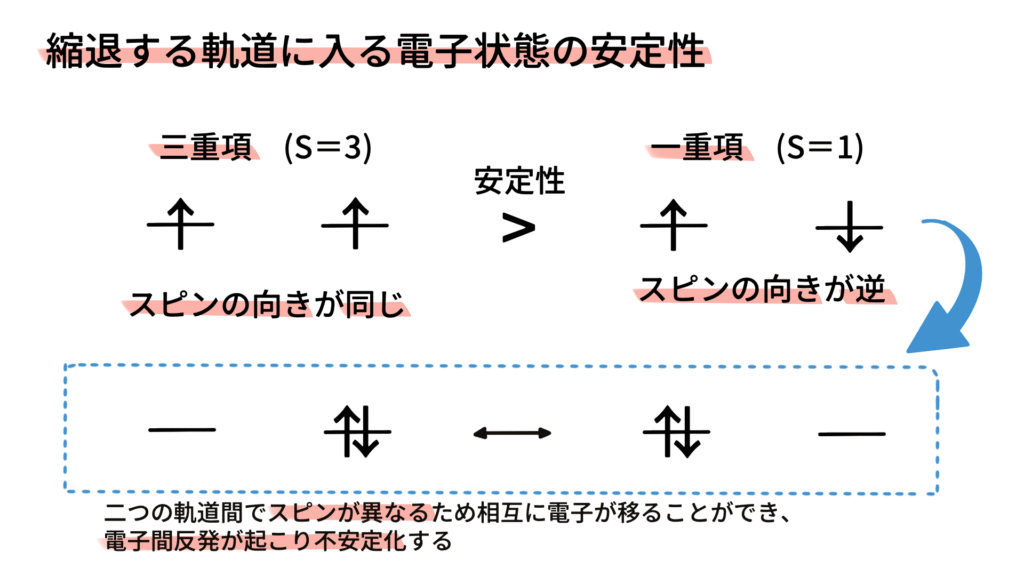
フントの規則はこのような効果の結果としてスピン多重度が最大となる時に最安定となります。
原子配置を決定手順
低周期元素を例に電子配置の決定手順を見ていきましょう。
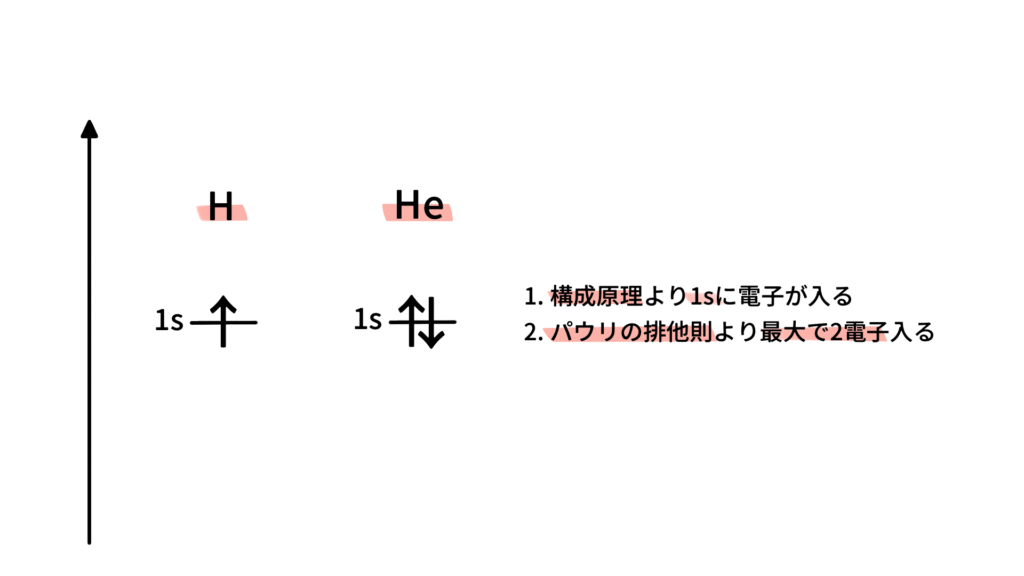
(1) 水素 1H:電子数 1
構成原理により、1s軌道に電子がはいります。
(2) ヘリウム 2He:電子数 2
構成原理より1s軌道に電子がはいります。また、パウリの排他原理より、2つの電子がスピンが逆向きで一つの軌道にはいります。
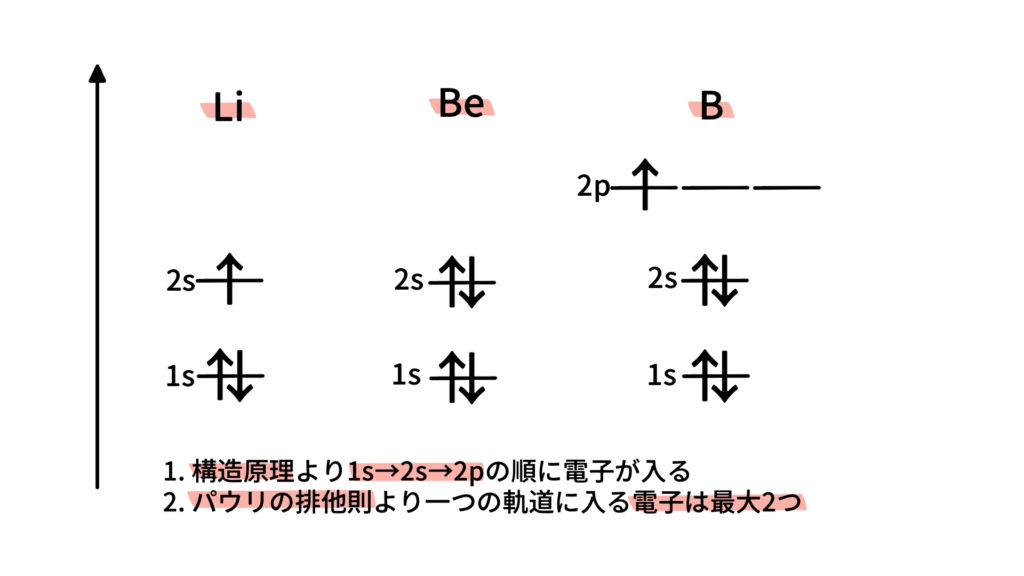
(3) リチウム 3Li:電子数 3
構成原理およびパウリの排他原理より1s軌道に2つ、2s軌道に1つの電子が入ります。
(4) ベリリウム 4Be:電子数 4
構成原理およびパウリの排他原理より1s軌道に2つ、2s軌道に2つの電子が入ります。
(5) ホウ素 5B:電子数 5
構成原理およびパウリの排他原理より1s軌道に2つ、2s軌道に2つ、2p軌道に1つ電子が入ります。
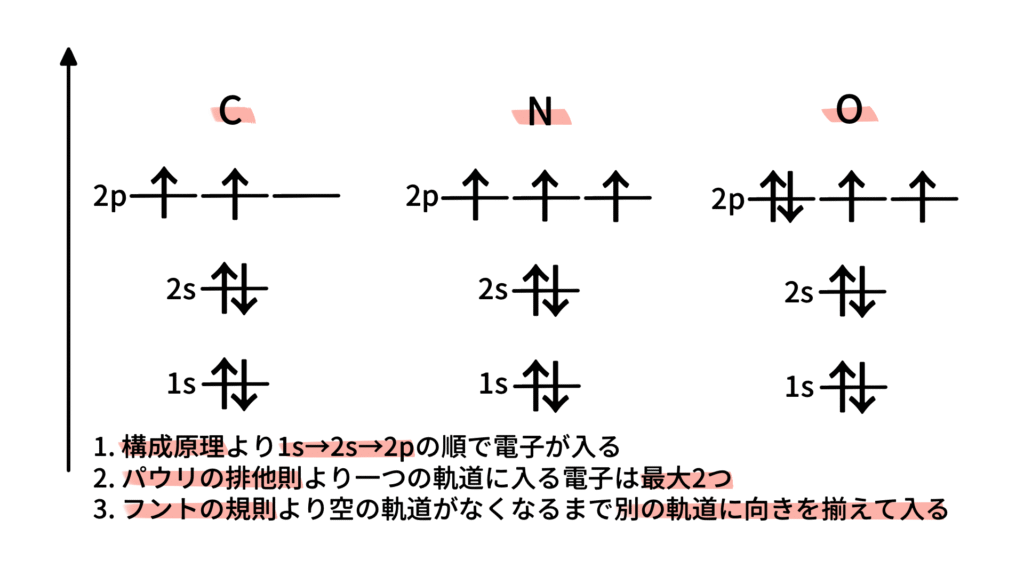
(6) 炭素 6C:電子数 6
構成原理およびパウリの排他原理より1s軌道に2つ、2s軌道に2つ、2p軌道に2つ電子が入ります。
2p軌道は縮退しているので、フントの規則により2つの電子は別々の軌道に向きを揃えて入ります。
(7) 窒素 7N:電子数
構成原理およびパウリの排他原理より1s軌道に2つ、2s軌道に2つ、2p軌道に3つ電子が入ります。
2p軌道は縮退しているので、フントの規則により3つの電子は別々の軌道に向きを揃えて入ります。
(8) 酸素 8O:電子数 8
構成原理およびパウリの排他原理より1s軌道に2つ、2s軌道に2つ、2p軌道に4つ電子が入ります。
2p軌道は縮退しているので、フントの規則により2つの電子がスピンを反対向きで1つの軌道に入り、残り2つの電子は残りの軌道に向きを揃えて入ります。
主要な原子の電子配置一覧
原子配置の表記方法
原子配置は原子軌道の名前(1s,2s,2p⋯)に上付き文字で入っている電子数を書くことで表記されます。
【例】炭素C の電子配置:1s22s22p2
内殻電子の省略表記
内殻電子は省略し、希ガス元素を用いて省略表記することが出来ます。
【例】炭素C の電子配置:[He]2s22p2
内殻電子の表記
[He] = 1s2
[Ne] = 1s22s22p6
[Ar] = 1s22s22p63s23p6
[Kr] = 1s22s22p63s23p63d104s24p6
元素の電子配置
| 周期 | 原子 | 電子配置 |
|---|---|---|
| 1 | 1H | 1s1 |
| 2He | 1s2 | |
| 2 | 3Li | [He]2s1 |
| 4Be | [He]2s2 | |
| 5B | [He]2s22p1 | |
| 6C | [He]2s22p2 | |
| 7N | [He]2s22p3 | |
| 8O | [He]2s22p4 | |
| 9F | [He]2s22p5 | |
| 10Ne | [He]2s22p6 | |
| 3 | 11Na | [Ne]3s1 |
| 12Mg | [Ne]3s2 | |
| 13Al | [Ne]3s23p1 | |
| 14Si | [Ne]3s23p2 | |
| 15P | [Ne]3s23p3 | |
| 16S | [Ne]3s23p4 | |
| 17Cl | [Ne]3s23p5 | |
| 18Ar | [Ne]3s23p6 | |
| 4 | 19K | [Ar]3d04s1 |
| 20Ca | [Ar]3d04s2 | |
| 21Sc | [Ar]3d14s2 | |
| 22Ti | [Ar]3d24s2 | |
| 23V | [Ar]3d34s2 | |
| 24Cr | [Ar]3d54s1 | |
| 25Mn | [Ar]3d54s2 | |
| 26Fe | [Ar]3d64s2 | |
| 27Co | [Ar]3d74s2 | |
| 28Ni | [Ar]3d84s2 | |
| 29Cu | [Ar]3d104s1 | |
| 30Zn | [Ar]3d104s2 | |
| 31Ga | [Ar]3d104s24p1 | |
| 32Ge | [Ar]3d104s24p2 | |
| 33As | [Ar]3d104s24p3 | |
| 34Se | [Ar]3d104s24p4 | |
| 35Br | [Ar]3d104s24p5 | |
| 36Kr | [Ar]3d104s24p6 | |
| 5 | 37Rb | [Kr]4d05s1 |
| 38Sr | [Kr]4d05s2 | |
| 39Y | [Kr]4d15s2 | |
| 40Zr | [Kr]4d25s2 | |
| 41Nb | [Kr]4d45s1 | |
| 42Mo | [Kr]4d55s1 | |
| 43Tc | [Kr]4d55s2 | |
| 44Ru | [Kr]4d75s1 | |
| 45Rh | [Kr]4d85s1 | |
| 46Pd | [Kr]4d105s0 | |
| 47Ag | [Kr]4d105s1 | |
| 48Cd | [Kr]4d105s2 | |
| 49In | [Kr]4d105s25p1 | |
| 50Sn | [Kr]4d105s25p2 | |
| 51Sb | [Kr]4d105s25p3 | |
| 52Te | [Kr]4d105s25p4 | |
| 53I | [Kr]4d105s25p5 | |
| 54Xe | [Kr]4d105s25p6 |
まとめ
構成原理、パウリの排他原理、フントの規則という3つのシンプルなルールを適用することで、さまざまな原子の電子配置を導き出すことができます。これらの規則を理解することは、周期表の構造や、原子がどのように結合を形成するのかを理解する上で不可欠です。